Aufgrund von steigenden Importzahlen von Hunden aus dem Ausland, zunehmendem Reiseverkehr sowie den Veränderungen klimatischer Bedingungen in Europa gewinnen Infektionen mit Leishmania (L.) infantum bei Hunden in Deutschland zunehmend an Bedeutung. Daher sollten auch Hunde aus dem Ausland, die keine klinischen Symptome zeigen, direkt nach Import sowie erneut 6 Monate später auf vektorübertragene Infektionserreger getestet werden. Bei Hunden mit klinischer Symptomatik, die hinweisend auf eine Leishmaniose sind, werden direkte und indirekte Nachweisverfahren sowie eine hämatologische und biochemische Untersuchung unter Einbezug von Serumeiweißelektrophorese sowie Bestimmung des C-reaktiven Proteins empfohlen. Als Leitfaden für die Therapie sowie das Monitoring stehen die LeishVet-Guidelines zur Verfügung. Es stehen leishmanizide und leishmaniostatische Wirkstoffe zur Verfügung, die in first-line, second-line und third-line unterschieden werden. Zur Anpassung der Allopurinol-Dosierung wird der Stufenplan empfohlen. Aufgrund der Veränderung der klimatischen Bedingungen kommt es zu einer Ausbreitung der Habitate von Sandmücken, die als Vektoren der Leishmaniose bekannt sind. Als weitere Infektionsquellen sind Deckakte, transplazentare Infektionen, Bisswunden und Bluttransfusionen beschrieben. Leishmania infantum hat zoonotisches Potential und ist daher auch in Hinblick auf den „One-Health“-Gedanken bedeutend.
Klinische Symptomatik
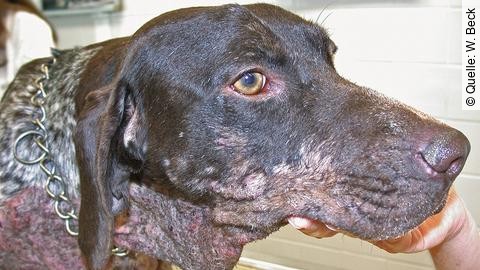
Die Leishmaniose zeichnet sich durch sehr lange Inkubationszeiten von Monaten bis hin zu Jahren aus [9]. Es handelt sich um eine chronische Erkrankung mit schleichend-progressivem Verlauf und einer sehr variablen klinischen Symptomatik [9]. Zusammenfassend lassen sich die klinischen Symptome nach den LeishVet-Guidelines in allgemeine, dermatologische, ophthalmologische und weitere Symptome einteilen [38]. Gemäß einer Literaturübersicht wurden bei Hunden mit klinischer Symptomatik hauptsächlich dermatologische Symptome (81–89 %), Lymphadenomegalie (62–90 %), ophthalmologische Symptome (16–81 %) und blasse Schleimhäute (81 %) beschrieben. Seltener traten Symptome wie Splenomegalie (10–53 %), Fieber (10–48 %), Krallenveränderungen (20–31 %) oder Nasenbluten (6–10 %) auf [39]. In frühen Phasen der Erkrankung sind die klinischen Symptome häufig noch sehr unspezifisch, wie z. B. Lethargie, Belastungsintoleranz, Gewichtsverlust, gastrointestinale Symptome oder Polyurie und Polydipsie [40], [41]. Weiterhin werden häufig progressive Lymphadenopathien [42] und Splenomegalien [39] beobachtet, gefolgt von dermatologischen Veränderungen ohne Juckreiz in unterschiedlichster Art und Ausprägung (z. B. Hyperkeratosen an Kopf/Nase/Ballen, Alopezie, Seborrhoe, multifokale kutane oder mukosale Ulzera) [43].
Eine Infektion mit L. infantum ist jedoch nicht gleichzusetzen mit einer klinischen Erkrankung, da ein hoher Prozentsatz infizierter Hunde subklinisch bleibt [8], [44]. Der Immunstatus des Hundes zum Zeitpunkt der Infektion beeinflusst die Entwicklung zu einer subklinischen Infektion, einer selbstlimitierenden Erkrankung, dem Auftreten von Symptomen zu einem späteren Zeitpunkt 3 Monate bis über 7 Jahre nach Infektion oder zu einer sofortigen schwerwiegenden klinischen Erkrankung [9].
Labordiagnostik
Aufgrund der unspezifischen klinischen Symptomatik spielt die Labordiagnostik bei der Leishmaniose eine bedeutende Rolle. Eine Unterscheidung zwischen Erregerkontakt, Infektion und klinischer Erkrankung ist erforderlich. Ebenfalls bedeutend ist die Identifikation subklinisch infizierter Hunde, da diese als Erregerreservoir fungieren können. Zur Diagnosestellung einer Infektion mit L. infantum sind direkte und indirekte Nachweisverfahren verfügbar.
Direkte Erregernachweise
Als direkte Erregernachweise stehen folgende Testverfahren zur Verfügung, die im Folgenden mit den Vor- und Nachteilen der jeweiligen Methodik diskutiert werden:
PCR (qualitativ und quantitativ)
Zytologische Untersuchungen
Histologische Untersuchungen
Erregeranzucht in Kulturen
PCR (qualitativ und quantitativ)
Ein direkter Erregernachweis mit Nachweis der Desoxyribonukleinsäure (DNA) der Leishmanien kann mittels qualitativer oder quantitativer PCR aus dem Knochenmark, dem peripheren Blut, Lymphknoten oder Hautläsionen durchgeführt werden. Im peripheren Blut sinkt allerdings bei Vorliegen einer geringen Anzahl amastigoter Stadien die Sensitivität des Erregernachweises [45], jedoch stellt dies ein schnelles und preiswertes Diagnostikum dar [9], [46]. Jeder Nachweis von Leishmanien-DNA in einer Probe beweist eine Infektion, ein negatives Ergebnis schließt eine Infektion jedoch nicht aus [47]. Die Verbindung von Infektion mit klinischer Erkrankung sollte bei der Leishmaniose unter Einbezug klinischer und klinisch-pathologischer Befunde bestätigt werden [47]. Auch eine PCR-Diagnostik aus Konjunktivalabstrichen ist beschrieben, allerdings werden zellreiche Präparate benötigt [48], [49].
In der Routinediagnostik werden mehrere PCR-Verfahren angeboten, wie z. B. „conventional PCR“, „nested PCR“ und die „real-time PCR“ mit qualitativem oder quantitativem Nachweis [9], [46], [47], [50]. Sensitivität und Spezifität sind neben dem verwendeten Probenmaterial auch abhängig von der Methodik und dem Zielgen der DNA-Sequenz variabel. Aktuell verwenden die meisten Anbieter „multicopy“ DNA-Sequenzen wie z. B. „small subunit ribosomal RNA“ oder „kinetoplast DNA minicircles“ mit der höchsten Sensitivität [51]. Diese Verfahren bieten 2 große Vorteile: zum einen ein geschlossenes System mit der Vermeidung von Kontaminationen der Proben sowie zum anderen Informationen über die Anzahl der Kopien von DNA in der Probe (Quantifizierung). Diese Quantifizierung kann vor allem beim therapeutischen Monitoring von großem Nutzen sein [52], [53]. Die PCR aus dem Knochenmark gilt hierbei als Goldstandard [54], stellt jedoch auch hinsichtlich der Probengewinnung das invasivste Verfahren dar.
Weiterhin können Lymphknoten- und Milzaspirate untersucht werden, vor allem bei klinisch kranken Hunden [9], [55], [56], [57], [58] unter der Voraussetzung einer geeigneten Probenqualität [47]. Bei Verwendung von beidseitigen Konjunktivalabstrichen oder auch oralen/nasalen Abstrichen ist die Sensitivität im Vergleich zu oben genannten Beprobungsarten geringer [48], [49], [56], [59], [60]. Die PCR-Diagnostik wird zur Identifizierung von subklinisch infizierten Hunden sowie zum Screening empfohlen mit einer Spezifität von annährend 100 % [39].
Zytologische Untersuchungen
Weitere direkte Untersuchungsverfahren neben der PCR-Diagnostik haben eine geringere Sensitivität. Ein zytologischer Erregernachweis kann in Hautläsionen, Lymphknoten und Knochenmark durchgeführt werden. Die Sensitivität ist abhängig von der Anzahl der Leishmanien im untersuchten Gewebe sowie der Qualität und Art des Untersuchungsmaterials [42], [61], [62]. So konnten beispielsweise in unter 0,5 % der Hunde mit einer Leishmanieninfektion amastigote Stadien in neutrophilen Granulozyten, Lymphozyten und Monozyten in Ausstrichen von peripher entnommenen Blutproben nachgewiesen werden [47], [63], [64].
Histologische Untersuchungen und Erregeranzucht in Kulturen
Auch histologische Untersuchungen aus Hautläsionen können für den Nachweis einer Leishmaniose durchgeführt werden und sind im positiven Fall beweisend, schließen bei negativem Ausgang die Infektion aber nicht aus [47]. Eine kulturelle Anzucht des Erregers ist möglich [47], wird aber aufgrund der langen Dauer nicht in der Routinediagnostik genutzt.
Indirekte Erregernachweise
Indirekte Verfahren weisen Antikörper gegen den jeweiligen Erreger nach. Ein positives Ergebnis wird zunächst als Folge eines Erregerkontaktes in der Vergangenheit interpretiert. Bei chronischen Infektionserkrankungen, wie der Leishmaniose, sind (vor allem hohe) Antikörpertiter jedoch zusätzlich auch beweisend für eine bestehende Infektion [9]. Weiterhin sollten mögliche Impfungen gegen Leishmanien im Anamnesegespräch abgefragt werden, da alle serologischen Verfahren nicht zwischen Antikörperbildung bei geimpften und infizierten Hunden differenzieren können [47].
Bedeutend ist weiterhin, dass Titerhöhen bzw. Ergebnisse bei Verwendung von Tests unterschiedlicher Hersteller variieren können [74], was den Vergleich von Ergebnissen unterschiedlicher Laboratorien erschwert. Therapiekontrollen sollten daher mit derselben Methodik in demselben Labor durchgeführt werden.
Folgende indirekte Nachweisverfahren sind möglich:
Antikörper-enzyme linked immunosorbent assay (Ak-ELISA)
Immunfluoreszenz-Antikörper-Test (IFAT)
Immunchromatographische Testverfahren (ICT)
Western-Blot
Latex-Agglutinationstests
Immunosensoren/Durchflusszytometrie
Am häufigsten werden 3 indirekte Nachweisverfahren in der Routinediagnostik verwendet: IFAT, Ak-ELISA sowie ICT. Der Zeitpunkt der Antikörperbildung ist variabel, es wurden in experimentellen Studien Zeiträume von 1–3 Monaten nach Infektion beschrieben [65]. Bei einzelnen Hunden wurden bei natürlichen Infektionen Zeiträume von 1–3 Monaten [66] bis hin zu 3 Jahren [67] nachgewiesen. Hohe Antikörpertiter sind beweisend für eine Infektion, bei niedrigen/grenzwertigen Antikörpertitern werden weitere zusätzliche diagnostische Verfahren empfohlen, wie beispielsweise hämatologische und klinisch-chemische Untersuchungen, eine Serumeiweißelektrophorese und ein PCR-Test bei klinischem Verdacht [9].
In einer Studie bei Hunden mit bekannter Leishmaniose, diagnostiziert mittels PCR oder Kultur, wurde der IFAT bei klinisch kranken Hunden als ein hoch sensitives (90 %) und spezifisches (annährend 100 %) Verfahren eingestuft, bei asymptomatischen Hunden lag die Sensitivität jedoch mit 29 % deutlich niedriger [68]. Weiterhin sind differentialdiagnostisch Kreuzreaktionen mit Trypanosma spp. und anderen Flagellaten zu berücksichtigen [69], die in Europa jedoch klinisch eine untergeordnete Rolle einnehmen. Auch die subjektive Festlegung des Titers beim IFAT durch den Untersucher am Mikroskop spielt vor allem bei grenzwertigen Titern eine Rolle.
Der Ak-ELISA ist abhängig vom verwendeten Antigen weniger kreuzreaktiv und bietet den Vorteil der Möglichkeit einer maschinellen Bearbeitung und Auswertung und daraus resultierender geringerer Streuung der Ergebnisse. Die Sensitivität liegt bei Hunden mit klinischen Symptomen zwischen 88 % und annährend 100 % sowie bei subklinisch infizierten Hunden bei 30 % bis annährend 100 % [68], [69].
Die ICT-Methode stellt die Basis aller Schnelltests dar, die derzeit aber nur qualitative Ergebnisse liefert [70]. Die Spezifität dieser Testverfahren variiert abhängig vom verwendeten Produkt, wird jedoch allgemein als akzeptabel eingestuft [47]. Die Sensitivität ist allerdings meist niedrig (30–70 %) und stark abhängig vom Stadium der Leishmaniose [47]. Die niedrigste Sensitivität wird bei Hunden ohne klinische Symptome erreicht, die höchste bei Hunden mit klinischer Erkrankung [71]. Bei einem Vergleich von 6 verschiedenen auf der ICT-Methodik basierenden Schnelltestverfahren mit den Ergebnissen eines IFAT und Ak-ELISA zeigten sich deutliche Unterschiede in der Sensitivität und Spezifität der einzelnen Schnelltests, so dass weitere Forschung an ICT-Testverfahren mit dem Ziel einer hohen Sensitivität und Spezifität empfohlen wurde [72]. Schnelltests können zur Vervollständigung der labordiagnostischen Aufarbeitung bei Hunden mit klinischem Verdacht angewandt werden, allerdings sollte immer ein Ak-ELISA oder IFAT zur Bestätigung durchgeführt werden [47]. Schnelltests sind nicht zum Screening bei asymptomatischen Tieren sowie nicht für seroepidemiologische Studien zu empfehlen.
Western Blots sind hoch sensitiv und spezifisch [73], [74], [75], [76], allerdings nicht in der Routinediagnostik etabliert. Die Durchführung von Latex-Agglutinationstests oder der Nachweis von Antikörpern durch Immunosensoren oder Durchflusszytometrie ist zwar möglich, wird aber als Routineuntersuchung nicht häufig nachgefragt [47].
Sonstige diagnostische Möglichkeiten
Hämatologische und klinisch-chemische Veränderungen sind sehr unspezifisch. Bei der kaninen Leishmaniose ist eine gering- bis mittelgradige normozytäre normochrome Anämie der häufigste hämatologische Befund, als deren Ursache ein chronisch-entzündlicher Prozess gilt [47]. Als weitere Faktoren werden eine verminderte Erythropoetin-Synthese aufgrund einer Nephropathie und eine Hämolyse bei wenigen Fällen mit positivem Coombs-Test vermutet [47]. Auch gering- bis mittelgradige Thrombozytopenien werden beobachtet, die höchstwahrscheinlich durch eine immunbedingte Zerstörung der Thrombozyten und Hyperkoagulabilität durch verminderte Antithrombin-Synthese aufgrund einer Proteinverlustnephropathie ausgelöst werden [47].
Klinisch-chemische Manifestationen können sich in Form von Hyperproteinämie mit Hyperglobulinämie sowie Hypoalbuminämie darstellen, vor allem bei Hunden mit hohen Antikörpertitern. Diese Veränderungen zeigen sich in der Serumeiweißelektrophorese meist als hochgradiger Anstieg der gamma-Globuline, vor allem bedingt durch hohe Immunoglobulin G (IgG)-Antikörpertiter und Immunkomplexe [47]. Diese Gammopathien sind typischerweise polyklonal, können sich aber auch als oligoklonale, biklonale [77] oder monoklonale [78] Veränderungen zeigen, vor allem bei Nutzung der Kapillarzonenelektrophorese [79]. Bei oligoklonalen, biklonalen oder monoklonalen Peaks sollten weitere vektorübertragene Infektionserkrankungen oder neoplastische Ursachen (z. B. multiple Myelome) differentialdiagnostisch berücksichtigt werden [47]. Weiterhin können gering- bis mittelgradige Erhöhungen bei den alpha-2-Globulinen auftreten, da sich hier die meisten Akute-Phase-Proteine abbilden [47]. Auch Proteinurie und renale Azotämie sind möglich [40], [47].
Screening
Idealerweise sollte beim Screening oder bei Verdacht auf eine Infektion mit L. infantum eine Kombination von PCR mit quantitativen serologischen Testverfahren unter Einbezug hämatologischer sowie klinisch-chemischer Ergebnisse sowie Urinuntersuchungen (Protein-Kreatinin-Quotient aus dem Urin [UPC]) zur Diagnosestellung durchgeführt werden [80].
Bezogen auf die Leishmaniose kann das C-reaktive Protein (CRP) als frühdiagnostischer Marker für das Monitoring des Ansprechens auf Therapie genutzt werden [81], [82]. Bei experimenteller Infektion stieg das CRP bereits an, bevor Antikörper nachgewiesen werden konnten [81]. Vor allem bei Hunden mit ausgeprägter klinischer Erkrankung (Stadium III und IV, [ Tab. 2 ]) wurde ein deutlicher CRP-Anstieg festgestellt [83]. Während sich die Serologie gut zum Nachweis einer Infektion eignet, ist die Aussage beim Monitoring klinisch kranker Hunde limitiert. Die Höhe der unspezifischen Entzündungsmarker wie CRP korreliert dagegen bis zu einem gewissen Grad mit dem Schweregrad der Erkrankung und kann zum Monitoring eingesetzt werden [84].
Eine weitere diagnostische Möglichkeit stellt die Durchflusszytometrie zur Immunphänotypisierung der Lymphozyten mit Bestimmung des CD4/CD8-Verhältnisses dar [47]. Bei Leishmanien-infizierten Hunden konnte eine nachlassende Th1-Immunantwort und ein erniedrigtes CD4/CD8-Verhältnis nachgewiesen werden [47]. Seropositive oder PCR-positive Hunde mit erniedrigtem CD4/CD8-Verhältnis werden daher als prädisponiert für die Entwicklung klinischer Symptome angesehen im Vergleich zu Hunden mit einem normalen Verhältnis [47]. Jedoch ist die Festlegung eines Cut-offs aufgrund der individuellen Unterschiede zwischen einzelnen Hunden schwierig. Daher wird das CD4/CD8-Verhältnis eher zum Monitoring nach Therapie als zum initialen Staging einer Leishmaniose-Infektion empfohlen [47].
Den ganzen Beitrag lesen
(RG)
1 Lane RP. Sandflies (Phlebotominae). In: Lane DRP, Crosskey DRW. eds. Medical insects and arachnids. Dordrecht, Netherlands: Springer; 1993: 78-119
2 Young DG, Perkins PV. Phlebotomine Sand Flies of North-America (Diptera, Psychodidae). Mosq News 1984; 44 (02) 263-304
3 Lewis DJ. A taxonomic review of the genus Phlebotomus (Diptera: Psychodidae). Bull Br Mus Nat Hist Entomol 1982; 45 (02) 121-209
4 Volf P, Hostomska J, Rohousova I. Molecular crosstalks in Leishmania-sandfly-host relationships. Parasite 2008; 15 (03) 237-243 DOI: 10.1051/parasite/2008153237.
5 Killick-Kendrick R. editor Biology of sand fly vectors of Mediterranean canine leishmaniasis. International Canine Leishmaniasis Forum. 1999 Barcelona, Spain
6 Dantas-Torres F. The role of dogs as reservoirs of Leishmania parasites, with emphasis on Leishmania (Leishmania) infantum and Leishmania (Viannia) braziliensis. Vet Parasitol 2007; 149 (03/04) 139-146 DOI: 10.1016/j.vetpar.2007.07.007.
7 Gramiccia M, Gradoni L. The current status of zoonotic leishmaniases and approaches to disease control. Int J Parasitol 2005; 35 (11/12) 1169-1180 DOI: 10.1016/j.ijpara.2005.07.001.
8 Baneth G, Koutinas AF, Solano-Gallego L. et al. Canine leishmaniosis – new concepts and insights on an expanding zoonosis: part one. Trends Parasitol 2008; 24 (07) 324-330 DOI: 10.1016/j.pt.2008.04.001.
9 Solano-Gallego L, Koutinas A, Miro G. et al. Directions for the diagnosis, clinical staging, treatment and prevention of canine leishmaniosis. Vet Parasitol 2009; 165 (01/02) 1-18 DOI: 10.1016/j.vetpar.2009.05.022.
10 Owens SD, Oakley DA, Marryott K. et al. Transmission of visceral leishmaniasis through blood transfusions from infected English foxhounds to anemic dogs. J Am Vet Med Assoc 2001; 219 (08) 1076-1083
11 de Freitas E, Melo MN, da Costa-Val AP. et al. Transmission of Leishmania infantum via blood transfusion in dogs: potential for infection and importance of clinical factors. Vet Parasitol 2006; 137 (01/02) 159-167 DOI: 10.1016/j.vetpar.2005.12.011.
12 Tabar MD, Roura X, Francino O. et al. Detection of Leishmania infantum by real-time PCR in a canine blood bank. J Small Anim Pract 2008; 49 (07) 325-328 DOI: 10.1111/j.1748-5827.2008.00542.x.
13 Silva FL, Oliveira RG, Silva TM. et al. Venereal transmission of canine visceral leishmaniasis. Vet Parasitol 2009; 160 (01/02) 55-59 DOI: 10.1016/j.vetpar.2008.10.079.
14 Rosypal AC, Troy GC, Zajac AM. et al. Transplacental transmission of a North American isolate of Leishmania infantum in an experimentally infected beagle. J Parasitol 2005; 91 (04) 970-972 DOI: 10.1645/GE-483R.1.
15 Pangrazio KK, Costa EA, Amarilla SP. et al. Tissue distribution of Leishmania chagasi and lesions in transplacentally infected fetuses from symptomatic and asymptomatic naturally infected bitches. Vet Parasitol 2009; 165 (03/04) 327-331 DOI: 10.1016/j.vetpar.2009.07.013.
16 Boggiatto PM, Gibson-Corley KN, Metz K. et al. Transplacental transmission of Leishmania infantum as a means for continued disease incidence in North America. PLoS Negl Trop Dis 2011; 5 (04) e1019 DOI: 10.1371/journal.pntd.0001019.
17 Shaw SE, Langton DA, Hillman TJ. Canine leishmaniosis in the United Kingdom: a zoonotic disease waiting for a vector?. Vet Parasitol 2009; 163 (04) 281-285 DOI: 10.1016/j.vetpar.2009.03.025.
18 Naucke TJ, Amelung S, Lorentz S. First report of transmission of canine leishmaniosis through bite wounds from a naturally infected dog in Germany. Parasite Vector 2016; 9 DOI: 10.1186/s13071-016-1551-0.
19 Coutinho MT, Bueno LL, Sterzik A. et al. Participation of Rhipicephalus sanguineus (Acari: Ixodidae) in the epidemiology of canine visceral leishmaniasis. Vet Parasitol 2005; 128 (01/02) 149-155 DOI: 10.1016/j.vetpar.2004.11.011.
20 Dantas-Torres F. Biology and ecology of the brown dog tick, Rhipicephalus sanguineus. Parasit Vectors 2010; 3: 26 DOI: 10.1186/1756-3305-3-26.
21 Paz GF, Ribeiro MF, de Magalhaes DF. et al. Association between the prevalence of infestation by Rhipicephalus sanguineus and Ctenocephalides felis felis and the presence of anti-Leishmania antibodies: A case-control study in dogs from a Brazilian endemic area. Prev Vet Med 2010; 97 (02) 131-133 DOI: 10.1016/j.prevetmed.2010.08.006.
22 Dantas-Torres F. Ticks as vectors of Leishmania parasites. Trends Parasitol 2011; 27 (04) 155-159 DOI: 10.1016/j.pt.2010.12.006.
23 Dantas-Torres F, Latrofa MS, Otranto D. Quantification of Leishmania infantum DNA in females, eggs and larvae of Rhipicephalus sanguineus. Parasit Vectors 2011; 4: 56 DOI: 10.1186/1756-3305-4-56.
24 Coutinho MTZ, Linardi PM. Can fleas from dogs infected with canine visceral leishmaniasis transfer the infection to other mammals?. Vet Parasitol 2007; 147 (03/04) 320-325 DOI: 10.1016/j.vetpar.2007.04.008.
25 Röhrig E, Hamel D, Pfister K. Retrospective evaluation of laboratory data on canine vector-borne infections from the years 2004–2008. Berl Munch Tierarztl Wochenschr 2011; 124 (09/10) 411-418 (In German)
26 Schäfer I, Volkmann M, Beelitz P. et al. Retrospective evaluation of vector-borne infections in dogs imported from the Mediterranean region and southeastern Europe (2007–2015). Parasit Vectors 2019; a; 12 (01) 30 DOI: 10.1186/s13071–018–3284–8.
27 Menn B, Lorentz S, Naucke TJ. Imported and travelling dogs as carriers of canine vector-borne pathogens in Germany. Parasit Vectors 2010; 3: 34 DOI: 10.1186/1756-3305-3-34.
28 Hamel D, Röhrig E, Pfister K. Canine vector-borne disease in travelled dogs in Germany--a retrospective evaluation of laboratory data from the years 2004–2008. Vet Parasitol 2011; 181 (01) 31-36 DOI: 10.1016/j.vetpar.2011.04.020.
29 Schäfer I, Volkmann M, Beelitz P. et al. Retrospective analysis of vector-borne infections in dogs after travelling to endemic areas (2007–2018). Vet Parasitol X 2: 100015 2019; b.
30 Hamel D, Silaghi C, Pfister K. Arthropod-borne infections in travelled dogs in Europe. Parasite 2013; 20: 9 10.1051/parasite/2013010
31 Gothe R. Leishmaniosen des Hundes in Deutschland: Erregerfauna und -biologie, Epidemiologie, Klinik, Pathogenese, Diagnose, Therapie und Prophylaxe. Kleintierpraxis 1991; 36: 69-84
32 Naucke TJ, Schmitt C. Is leishmaniasis becoming endemic in Germany?. Int J Med Microbiol 2004; 293 (Suppl. 37) 179-181
33 Naucke TJ, Pesson B. Presence of Phlebotomus (Transphlebotomus) mascittii Grassi, 1908 (Diptera : Psychodidae) in Germany. Parasitol Res 2000; 86 (04) 335-336
34 Naucke TJ, Menn B, Massberg D. et al. Sandflies and leishmaniasis in Germany. Parasitol Res 2008; 103 (Suppl. 01) S65-68 10.1007/s00436-008-1052-y
35 Melaun C, Kruger A, Werblow A. et al. New record of the suspected leishmaniasis vector Phlebotomus (Transphlebotomus) mascittii Grassi, 1908 (Diptera: Psychodidae: Phlebotominae)--the northernmost phlebotomine sandfly occurrence in the Palearctic region. Parasitol Res 2014; 113 (06) 2295-2301 DOI: 10.1007/s00436-014-3884-y.
36 Obwaller AG, Karakus M, Poeppl W. et al. Could Phlebotomus mascittii play a role as a natural vector for Leishmania infantum? New data. Parasit Vectors 2016; 9: 458 DOI: 10.1186/s13071-016-1750-8.
37 Fischer D, Thomas SM, Beierkuhnlein C. Temperature-derived potential for the establishment of phlebotomine sandflies and visceral leishmaniasis in Germany. Geospat Health 2010; 5 (01) 59-69 DOI: 10.4081/gh.2010.187.
38 Solano-Gallego L, Miro G, Koutinas A. et al. LeishVet guidelines for the practical management of canine leishmaniosis. Parasit Vectors 2011; 4: 86 DOI: 10.1186/1756-3305-4-86.
39 Baneth G, Aroch I. Canine leishmaniasis: a diagnostic and clinical challenge. Vet J 2008; 175 (01) 14-15 DOI: 10.1016/j.tvjl.2006.11.011.
40 Baneth G, Solano-Gallego L. Leishmaniasis. In: Greene CE. editor. Infectious Diseases of the Dog and Cat. 4th edn.. Oxford: Elsevier; 2012: 734-749
41 Gharbi M, Mhadhbi M, Rejeb A. et al. Leishmaniosis (Leishmania infantum infection) in dogs. Rev Sci Tech 2015; 34 (02) 613-626
42 Ciaramella P, Oliva G, Luna RD. et al. A retrospective clinical study of canine leishmaniasis in 150 dogs naturally infected by Leishmania infantum. Vet Rec 1997; 141 (21) 539-543
43 Blavier A, Keroack S, Denerolle P. et al. Atypical forms of canine leishmaniosis. Vet J 2001; 162 (02) 108-120 DOI: 10.1053/tvjl.2000.0556.
44 Iniesta L, Fernandez-Barredo S, Bulle B. et al. Diagnostic techniques to detect cryptic leishmaniasis in dogs. Clin Diagn Lab Immunol 2002; 9 (05) 1137-1141
45 Chulay JD, Bryceson AD. Quantitation of amastigotes of Leishmania donovani in smears of splenic aspirates from patients with visceral leishmaniasis. Am J Trop Med Hyg 1983; 32 (03) 475-479
46 Paltrinieri S, Solano-Gallego L, Fondati A. et al. Guidelines for diagnosis and clinical classification of leishmaniasis in dogs. J Am Vet Med Assoc 2010; 236 (11) 1184-1191 DOI: 10.2460/javma.236.11.1184.
47 Paltrinieri S, Gradoni L, Roura X. et al. Laboratory tests for diagnosing and monitoring canine leishmaniasis. Vet Clin Pathol 2016; 45 (04) 552-578 DOI: 10.1111/vcp.12413.
48 Ferreira Sde A, Ituassu LT, de Melo MN. et al. Evaluation of the conjunctival swab for canine visceral leishmaniasis diagnosis by PCR-hybridization in Minas Gerais State, Brazil. Vet Parasitol 2008; 152 (03/04) 257-263 DOI: 10.1016/j.vetpar.2007.12.022.
49 Gramiccia M, Di Muccio T, Fiorentino E. et al. Longitudinal study on the detection of canine Leishmania infections by conjunctival swab analysis and correlation with entomological parameters. Vet Parasitol 2010; 171 (03/04) 223-228 DOI: 10.1016/j.vetpar.2010.03.025.
50 EFSA Panel on Animal Health and Welfare. Scientific opinion on canine leishmaniosis. EFSA Journal 2015; 13: 4075
51 Cortes S, Rolao N, Ramada J. et al. PCR as a rapid and sensitive tool in the diagnosis of human and canine leishmaniasis using Leishmania donovani s. l. specific kinetoplastid primers. Trans R Soc Trop Med Hyg 2004; 98: 12-17
52 Francino O, Altet L, Sanchez-Robert E. et al. Advantages of real-time PCR assay for diagnosis and monitoring of canine leishmaniosis. Vet Parasitol 2006; 137 (03/04) 214-221 DOI: 10.1016/j.vetpar.2006.01.011.
53 Martinez V, Quilez J, Sanchez A. et al. Canine leishmaniasis: the key points for qPCR result interpretation. Parasit Vectors 2011; 4: 57 DOI: 10.1186/1756-3305-4-57.
54 Andrade HM, de Toledo VDCP, Marques MJ. et al. Leishmania (Leishmania) chagasi is not vertically transmitted in dogs. Vet Parasitol 2002; 103 (01/02) 71-81 DOI: 10.1016/S0304–4017(01)00552–0.
55 Ramos RA, Ramos CA, Santos EM. et al. Quantification of Leishmania infantum DNA in the bone marrow, lymph node and spleen of dogs. Rev Bras Parasitol Vet 2013; 22 (03) 346-350 DOI: 10.1590/S1984-29612013000300005.
56 Carvalho Ferreira AL, Carregal VM, de Almeida Ferreira S. et al. Detection of Leishmania infantum in 4 different dog samples by real-time PCR and ITS-1 nested PCR. Diagn Microbiol Infect Dis 2014; 78 (04) 418-421 DOI: 10.1016/j.diagmicrobio.2013.10.015.
57 Almeida AB, Sousa VR, Gasparetto ND. et al. Canine visceral leishmaniasis: diagnostic approaches based on polymerase chain reaction employing different biological samples. Diagn Microbiol Infect Dis 2013; 76 (03) 321-324 DOI: 10.1016/j.diagmicrobio.2013.03.017.
58 Reis LE, Coura-Vital W, Roatt BM. et al. Molecular diagnosis of canine visceral leishmaniasis: a comparative study of three methods using skin and spleen from dogs with natural Leishmania infantum infection. Vet Parasitol 2013; 197 (03/04) 498-503 DOI: 10.1016/j.vetpar.2013.07.006.
59 Di Muccio T, Veronesi F, Antognoni MT. et al. Diagnostic value of conjunctival swab sampling associated with nested PCR for different categories of dogs naturally exposed to Leishmania infantum infection. J Clin Microbiol 2012; 50 (08) 2651-2659 DOI: 10.1128/JCM.00558-12.
60 Ferreira Sde A, Almeida GG, Silva Sde O. et al. Nasal, oral and ear swabs for canine visceral leishmaniasis diagnosis: new practical approaches for detection of Leishmania infantum DNA. PLoS Negl Trop Dis 2013; 7 (04) e2150 DOI: 10.1371/journal.pntd.0002150.
61 Saridomichelakis MN, Mylonakis ME, Leontides LS. et al. Evaluation of lymph node and bone marrow cytology in the diagnosis of canine leishmaniasis (Leishmania infantum) in symptomatic and asymptomatic dogs. Am J Trop Med Hyg 2005; 73 (01) 82-86
62 Moreira MA, Luvizotto MC, Garcia JF. et al. Comparison of parasitological, immunological and molecular methods for the diagnosis of leishmaniasis in dogs with different clinical signs. Vet Parasitol 2007; 145 (03/04) 245-252 DOI: 10.1016/j.vetpar.2006.12.012.
63 Giudice E, Passantino A. Detection of Leishmania amastigotes in peripheral blood from four dogs--Short communication. Acta Vet Hung 2011; 59 (02) 205-213 DOI: 10.1556/AVet.2011.003.
64 Ruiz De Gopegui R, Espada Y. Peripheral blood and abdominal fluid from a dog with abdominal distention. Vet Clin Pathol 1998; 27 (02) 64 DOI: 10.1111/j.1939-165x.1998.tb01019.x.
65 Moreno J, Alvar J. Canine leishmaniasis: epidemiological risk and the experimental model. Trends Parasitol 2002; 18 (09) 399-405
66 Quinnell RJ, Courtenay O, Garcez LM. et al. IgG subclass responses in a longitudinal study of canine visceral leishmaniasis. Vet Immunol Immunopathol 2003; 91 (03/04) 161-168
67 Solano-Gallego L, Llull J, Ramis A. et al. Longitudinal study of dogs living in an area of Spain highly endemic for leishmaniasis by serologic analysis and the leishmanin skin test. Am J Trop Med Hyg 2005; 72 (06) 815-818
68 Mettler M, Grimm F, Capelli G. et al. Evaluation of enzyme-linked immunosorbent assays, an immunofluorescent-antibody test, and two rapid tests (immunochromatographic-dipstick and gel tests) for serological diagnosis of symptomatic and asymptomatic Leishmania infections in dogs. J Clin Microbiol 2005; 43 (11) 5515-5519 DOI: 10.1128/Jcm.43.11.5515-5519.2005.
69 Ferreira Ede C, de Lana M, Carneiro M. et al. Comparison of serological assays for the diagnosis of canine visceral leishmaniasis in animals presenting different clinical manifestations. Vet Parasitol 2007; 146 (03/04) 235-241 DOI: 10.1016/j.vetpar.2007.02.015.
70 Maia C, Campino L. Methods for diagnosis of canine leishmaniasis and immune response to infection. Vet Parasitol 2008; 158 (04) 274-287 DOI: 10.1016/j.vetpar.2008.07.028.
71 Grimaldi Jr. G, Teva A, Ferreira AL. et al. Evaluation of a novel chromatographic immunoassay based on Dual-Path Platform technology (DPP(R) CVL rapid test) for the serodiagnosis of canine visceral leishmaniasis. Trans R Soc Trop Med Hyg 2012; 106 (01) 54-59 DOI: 10.1016/j.trstmh.2011.10.001.
72 Villanueva-Saz S, Martínez M, Ramirez JD. et al. Evaluation of five different rapid immunochromatographic tests for canine leishmaniosis in Spain. Acta Trop 2022; 229: 106371
73 Sousa S, Cardoso L, Reed SG. et al. Development of a fluorescent based immunosensor for the serodiagnosis of canine leishmaniasis combining immunomagnetic separation and flow cytometry. PLoS Negl Trop Dis 2013; 7 (08) e2371 DOI: 10.1371/journal.pntd.0002371.
74 Ker HG, Coura-Vital W, Aguiar-Soares RD. et al. Evaluation of a prototype flow cytometry test for serodiagnosis of canine visceral leishmaniasis. Clin Vaccine Immunol 2013; 20 (12) 1792-1798 DOI: 10.1128/CVI.00575-13.
75 Ramos-Jesus J, Carvalho KA, Fonseca RA. et al. A piezoelectric immunosensor for Leishmania chagasi antibodies in canine serum. Anal Bioanal Chem 2011; 401 (03) 917-925 DOI: 10.1007/s00216-011-5136-7.
76 Akhoundi B, Mohebali M, Shojaee S. et al. Rapid detection of human and canine visceral leishmaniasis: assessment of a latex agglutination test based on the A2 antigen from amastigote forms of Leishmania infantum. Exp Parasitol 2013; 133 (03) 307-313 DOI: 10.1016/j.exppara.2012.12.002.
77 Facchini RV, Bertazzolo W, Zuliani D. et al. Detection of biclonal gammopathy by capillary zone electrophoresis in a cat and a dog with plasma cell neoplasia. Vet Clin Pathol 2010; 39 (04) 440-446 DOI: 10.1111/j.1939-165X.2010.00259.x.
78 Antognoni MT, Birettoni F, Miglio A. et al. Monoclonal gammopathy associated with multiple myeloma and visceral leishmaniasis in the dog: a comparison of two cases. Vet Res Commun 2010; 34 (Suppl. 01) S97-101 DOI: 10.1007/s11259-010-9365-6.
79 Giordano A, Paltrinieri S. Interpretation of capillary zone electrophoresis compared with cellulose acetate and agarose gel electrophoresis: reference intervals and diagnostic efficiency in dogs and cats. Vet Clin Pathol 2010; 39 (04) 464-473 DOI: 10.1111/j.1939-165X.2010.00255.x.
80 ESCCAP. Control of Vector-Borne Diseases in Dogs and Cats. Series Eds. editor^editors: European Scientific Counsel Companion Animal Parasites. 2019
81 Martinez-Subiela S, Strauss-Ayali D, Ceron JJ. et al. Acute phase protein response in experimental canine leishmaniasis. Vet Parasitol 2011; 180 (03/04) 197-202 DOI: 10.1016/j.vetpar.2011.03.032.
82 Daza Gonzalez MA, Fragio Arnold C, Fermin Rodriguez M. et al. Effect of two treatments on changes in serum acute phase protein concentrations in dogs with clinical leishmaniosis. Vet J 2019; 245: 22-28 DOI: 10.1016/j.tvjl.2018.12.020.
83 Pardo-Marin L, Ceron JJ, Tecles F. et al. Comparison of acute phase proteins in different clinical classification systems for canine leishmaniosis. Vet Immunol Immunopathol 2020; 219: 109958 DOI: 10.1016/j.vetimm.2019.109958.
84 Cantos-Barreda A, Escribano D, Ceron JJ. et al. Relationship between serum anti-Leishmania antibody levels and acute phase proteins in dogs with canine leishmaniosis. Vet Parasitol 2018; 260: 63-68 DOI: 10.1016/j.vetpar.2018.08.010.
85 Denerolle P, Bourdoiseau G. Combination allopurinol and antimony treatment versus antimony alone and allopurinol alone in the treatment of canine leishmaniasis (96 cases). J Vet Intern Med 1999; 13 (05) 413-415 DOI: 10.1892/0891–6640(1999)013<0413:caaatv>2.3.co;2L42:URLEND.
86 Noli C, Auxilia ST. Treatment of canine Old World visceral leishmaniasis: a systematic review. Vet Dermatol 2005; 16 (04) 213-232 DOI: 10.1111/j.1365-3164.2005.00460.x.
87 Manna L, Reale S, Vitale F. et al. Real-time PCR assay in Leishmania-infected dogs treated with meglumine antimoniate and allopurinol. Vet J 2008; 177 (02) 279-282 DOI: 10.1016/j.tvjl.2007.04.013.
88 Miro G, Oliva G, Cruz I. et al. Multicentric, controlled clinical study to evaluate effectiveness and safety of miltefosine and allopurinol for canine leishmaniosis. Vet Dermatol 2009; 20 (05/06) 397-404 DOI: 10.1111/j.1365-3164.2009.00824.x.
89 Mary C, Faraut F, Deniau M. et al. Frequency of drug resistance gene amplification in clinical leishmania strains. Int J Microbiol 2010; 2010 DOI: 10.1155/2010/819060.
90 Sundar S, Singh A, Rai M. et al. Single-dose indigenous liposomal amphotericin B in the treatment of Indian visceral leishmaniasis: a phase 2 study. Am J Trop Med Hyg 2015; 92 (03) 513-517 DOI: 10.4269/ajtmh.14-0259.
91 Monge-Maillo B, Lopez-Velez R. Therapeutic options for visceral leishmaniasis. Drugs 2013; 73 (17) 1863-1888 DOI: 10.1007/s40265-013-0133-0.
92 Poli A, Sozzi S, Guidi G. et al. Comparison of aminosidine (paromomycin) and sodium stibogluconate for treatment of canine leishmaniasis. Vet Parasitol 1997; 71 (04) 263-271 DOI: 10.1016/s0304-4017(97)00014-9.
93 Oliva G, Gradoni L, Cortese L. et al. Comparative efficacy of meglumine antimoniate and aminosidine sulphate, alone or in combination, in canine leishmaniasis. Ann Trop Med Parasitol 1998; 92 (02) 165-171 DOI: 10.1080/00034989860003.
94 Rhalem A, Sahibi H, Lasri S. et al. Analysis of immune responses in dogs with canine visceral leishmaniasis before, and after, drug treatment. Vet Immunol Immunopathol 1999; 71: 69-76
95 Pennisi MG, De Majo M, Masucci M. et al. Efficacy of the treatment of dogs with leishmaniosis with a combination of metronidazole and spiramycin. Vet Rec 2005; 156 (11) 346-349 DOI: 10.1136/vr.156.11.346.
96 Segarra S, Miro G, Montoya A. et al. Prevention of disease progression in Leishmania infantum-infected dogs with dietary nucleotides and active hexose correlated compound. Parasit Vectors 2018; 11 (01) 103 DOI: 10.1186/s13071-018-2705-z.
97 Segarra S, Miro G, Montoya A. et al. Randomized, allopurinol-controlled trial of the effects of dietary nucleotides and active hexose correlated compound in the treatment of canine leishmaniosis. Vet Parasitol 2017; 239: 50-56 DOI: 10.1016/j.vetpar.2017.04.014.
98 Travi BL, Miro G. Use of domperidone in canine visceral leishmaniasis: gaps in veterinary knowledge and epidemiological implications. Mem Inst Oswaldo Cruz 2018; 113 (11) e180301
99 Cavalera MA, Gernone F, Uva A. et al. Effect of domperidone (leisguard(R)) on antibody titers, inflammatory markers and creatinine in dogs with leishmaniosis and chronic kidney disease. Parasit Vectors 2021; 14 (01) 525 DOI: 10.1186/s13071-021-05030-8.
100 Orav A, Raal A, Arak E. Content and composition of the essential oil of Chamomilla recutita (L.) Rauschert from some European countries. Nat Prod Res 2010; 24 (01) 48-55 DOI: 10.1080/14786410802560690.
101 Forrer M, Kulik EM, Filippi A. et al. The antimicrobial activity of alpha-bisabolol and tea tree oil against Solobacterium moorei, a Gram-positive bacterium associated with halitosis. Arch Oral Biol 2013; 58 (01) 10-16 DOI: 10.1016/j.archoralbio.2012.08.001.
102 Maurya AK, Singh M, Dubey V. et al. alpha-(-)-bisabolol reduces pro-inflammatory cytokine production and ameliorates skin inflammation. Curr Pharm Biotechnol 2014; 15 (02) 173-181 DOI: 10.2174/1389201015666140528152946.
103 Bhatia SP, McGinty D, Letizia CS. et al. Fragrance material review on alpha-bisabolol. Food Chem Toxicol 2008; 46 (Suppl. 11) S72-76 DOI: 10.1016/j.fct.2008.06.025.
104 Corpas-Lopez V, Merino-Espinosa G, Lopez-Viota M. et al. Topical treatment of Leishmania tropica infection using (-)-alpha-Bisabolol ointment in a hamster model: effectiveness and safety assessment. J Nat Prod 2016; 79 (09) 2403-2407 DOI: 10.1021/acs.jnatprod.6b00740.
105 Corpas-Lopez V, Morillas-Marquez F, Navarro-Moll MC. et al. (-)-alpha-Bisabolol, a promising oral compound for the treatment of visceral leishmaniasis. J Nat Prod 2015; 78 (06) 1202-1207 DOI: 10.1021/np5008697.
106 Corpas-Lopez V, Merino-Espinosa G, Acedo-Sanchez C. et al. Effectiveness of the sesquiterpene (-)-alpha-bisabolol in dogs with naturally acquired canine leishmaniosis: an exploratory clinical trial. Vet Res Commun 2018; 42 (02) 121-130 DOI: 10.1007/s11259-018-9714-4.
107 Shakir L, Hussain M, Javeed A. et al. Artemisinins and immune system. European Journal of Pharmacology 2011; 668 (01/02) 6-14
108 Tejada R. Artemisia annua contra la leishmaniosis canina: cuatro casos clinicos. Revista de Fitoterapia 2016; 16: 123-129
109 Zaidi A, Singh KP, Ali V. Leishmania and its quest for iron: An update and overview. Mol Biochem Parasitol 2017; 211: 15-25
110 Niu Q, Li S, Chen D. et al. Iron acquisition in Leishmania and its crucial role in infection. Parasitol 2016; 143 (11) 1347-1357
111 LupoVet GmbH – veterinary diets. Im Internt: Zugriff am 04. Januar 2022 unter: https://www.lupovet.de/produkte/ergaenzer-fuer-hunde/lupovet-ergaenzer-a-z/42/luparte-2.0
112 Helm M, Müller W, Schaarschmidt-Kiener D. et al. Allopurinol-Therapie bei importierten Hunden mit Leishmaniose außerhalb des Endemiegebietes. Schweiz Arch Tierheilkd 2013; 155: 559-567
113 Yasur-Landau D, Jaffe CL, David L. et al. Allopurinol resistance in Leishmania infantum from dogs with disease relapse. PLoS Negl Trop Dis 2016; 10 (01) e0004341 DOI: 10.1371/journal.pntd.0004341.
114 Yasur-Landau D, Jaffe CL, David L. et al. Resistance of Leishmania infantum to allopurinol is associated with chromosome and gene copy number variations including decrease in the S-adenosylmethionine synthetase (METK) gene copy number. Int J Parasitol-Drug 2018; 8 (03) 403-410 DOI: 10.1016/j.ijpddr.2018.08.002.
115 Yasur-Landau D, Jaffe CL, Doron-Faigenboim A. et al. Induction of allopurinol resistance in Leishmania infantum isolated from dogs. PLoS Negl Trop Dis 2017; 11 (09) e0005910 DOI: 10.1371/journal.pntd.0005910.
116 Geisweid K, Mueller R, Sauter-Louis C. et al. Prognostic analytes in dogs with Leishmania infantum infection living in a non-endemic area. Vet Rec 2012; 171 (16) 399 DOI: 10.1136/vr.100637.
117 Jacob F, Polzin DJ, Osborne CA. et al. Evaluation of the association between initial proteinuria and morbidity rate or death in dogs with naturally occurring chronic renal failure. J Am Vet Med Assoc 2005; 226 (03) 393-400 DOI: 10.2460/javma.2005.226.393.
118 International renal Interest Society (IRIS). Guidelines for Staging Chronic Kidney Disease (CKD). Im Internet: Zugriff am 24. Dezember 2021 unter: www.iris-kidney.com
119 Roura X, Fondati A, Lubas G. et al. Prognosis and monitoring of leishmaniasis in dogs: a working group report. Vet J 2013; 198 (01) 43-47 DOI: 10.1016/j.tvjl.2013.04.001.
120 Group IGDS, Goldstein RE, Brovida C. et al. Consensus recommendations for treatment for dogs with serology positive glomerular disease. J Vet Intern Med 2013; 27 (Suppl. 01) S60-66 DOI: 10.1111/jvim.12232.
121 Rossi G, Ibba F, Meazzi S. et al. Paraoxonase activity as a tool for clinical monitoring of dogs treated for canine leishmaniasis. Vet J 2014; 199 (01) 143-149 DOI: 10.1016/j.tvjl.2013.10.007.
122 Torres M, Bardagi M, Roura X. et al. Long term follow-up of dogs diagnosed with leishmaniosis (clinical stage II) and treated with meglumine antimoniate and allopurinol. Vet J 2011; 188 (03) 346-351 DOI: 10.1016/j.tvjl.2010.05.025.
123 Rougier S, Hasseine L, Delaunay P. et al. One-year clinical and parasitological follow-up of dogs treated with marbofloxacin for canine leishmaniosis. Vet Parasitol 2012; 186 (03/04) 245-253 DOI: 10.1016/j.vetpar.2011.11.016.
124 Manna L, Corso R, Galiero G. et al. Long-term follow-up of dogs with leishmaniosis treated with meglumine antimoniate plus allopurinol versus miltefosine plus allopurinol. Parasit Vectors 2015; 8: 289 DOI: 10.1186/s13071-015-0896-0.
125 Solano-Gallego L, Di Filippo L, Ordeix L. et al. Early reduction of Leishmania infantum-specific antibodies and blood parasitemia during treatment in dogs with moderate or severe disease. Parasit Vectors 2016; 9 (01) 235 DOI: 10.1186/s13071-016-1519-0.
126 Martinez-Subiela S, Bernal LJ, Ceron JJ. Serum concentrations of acute-phase proteins in dogs with leishmaniosis during short-term treatment. Am J Vet Res 2003; 64 (08) 1021-1026 DOI: 10.2460/ajvr.2003.64.1021.
127 Sasanelli M, Paradies P, de Caprariis D. et al. Acute-phase proteins in dogs naturally infected with Leishmania infantum during and after long-term therapy with allopurinol. Vet Res Commun 2007; 31 (Suppl. 01) 335-338 DOI: 10.1007/s11259-007-0060-1.
128 Aresu L, Benali S, Ferro S. et al. Light and electron microscopic analysis of consecutive renal biopsy specimens from Leishmania-seropositive dogs. Vet Pathol 2013; 50 (05) 753-760 DOI: 10.1177/0300985812459336.
129 Bianciardi P, Brovida C, Valente M. et al. Administration of miltefosine and meglumine antimoniate in healthy dogs: clinicopathological evaluation of the impact on the kidneys. Toxicol Pathol 2009; 37 (06) 770-775 DOI: 10.1177/0192623309344088.
130 Xenoulis PG, Saridomichelakis MN, Chatzis MK. et al. Prospective evaluation of serum pancreatic lipase immunoreactivity and troponin I concentrations in Leishmania infantum-infected dogs treated with meglumine antimonate. Vet Parasitol 2014; 203 (03/04) 326-330 DOI: 10.1016/j.vetpar.2014.03.033.
131 Luciani A, Sconza S, Civitella C. et al. Evaluation of the cardiac toxicity of N-methyl-glucamine antimoniate in dogs with naturally occurring leishmaniasis. Vet J 2013; 196 (01) 119-121 DOI: 10.1016/j.tvjl.2012.08.013.
132 Aste G, Di Tommaso M, Steiner JM. et al. Pancreatitis associated with N-methyl-glucamine therapy in a dog with leishmaniasis. Vet Res Commun 2005; 29 (Suppl. 02) 269-272 DOI: 10.1007/s11259-005-0059-4.
133 Torres M, Pastor J, Roura X. et al. Adverse urinary effects of allopurinol in dogs with leishmaniasis. J Small Anim Pract 2016; 57 (06) 299-304 DOI: 10.1111/jsap.12484.
134 Osborne CA, Lulich JP, Swanson LL. et al. Drug-induced urolithiasis. Vet Clin North Am Small Anim Pract 2009; 39 (01) 55-63 DOI: 10.1016/j.cvsm.2008.09.004.
135 Roura X, Cortadellas O, Day MJ. et al. Canine leishmaniosis and kidney disease: Q & A for an overall management in clinical practice. J Small Anim Pract 2021; 62 (01) E1-E19 DOI: 10.1111/jsap.13237.
136 Dantas-Torres F, Miro G, Baneth G. et al. Canine leishmaniasis control in the context of one health. Emerg Infect Dis. 2019 25. 12
137 Miro G, Galvez R, Mateo M. et al. Evaluation of the efficacy of a topically administered combination of imidacloprid and permethrin against Phlebotomus perniciosus in dog. Vet Parasitol 2007; 143 (03/04) 375-379 DOI: 10.1016/j.vetpar.2006.09.014.
138 Mencke N, Volf P, Volfova V. et al. Repellent efficacy of a combination containing imidacloprid and permethrin against sand flies (Phlebotomus papatasi) in dogs. Parasitol Res 2003; 90 (Suppl. 03) S108-111 DOI: 10.1007/s00436-003-0905-7.
139 Killick-Kendrick R, Killick-Kendrick M, Focheux C. et al. Protection of dogs from bites of phlebotomine sandflies by deltamethrin collars for control of canine leishmaniasis. Med Vet Entomol 1997; 11 (02) 105-111 DOI: 10.1111/j.1365-2915.1997.tb00298.x.
140 Otranto D, Paradies P, Lia RP. et al. Efficacy of a combination of 10 % imidacloprid/50 % permethrin for the prevention of leishmaniasis in kennelled dogs in an endemic area. Vet Parasitol 2007; 144 (03/04) 270-278 DOI: 10.1016/j.vetpar.2006.09.012.
141 Maroli M, Mizzoni V, Siragusa C. et al. Evidence for an impact on the incidence of canine leishmaniasis by the mass use of deltamethrin-impregnated dog collars in southern Italy. Med Vet Entomol 2001; 15 (04) 358-363 DOI: 10.1046/j.0269-283x.2001.00321.x.
142 Foglia Manzillo V, Oliva G, Pagano A. et al. Deltamethrin-impregnated collars for the control of canine leishmaniasis: evaluation of the protective effect and influence on the clinical outcome of Leishmania infection in kennelled stray dogs. Vet Parasitol 2006; 142 (01/02) 142-145 DOI: 10.1016/j.vetpar.2006.06.029.
143 Otranto D, de Caprariis D, Lia RP. et al. Prevention of endemic canine vector-borne diseases using imidacloprid 10 % and permethrin 50 % in young dogs: a longitudinal field study. Vet Parasitol 2010; 172 (03/04) 323-332 DOI: 10.1016/j.vetpar.2010.05.017.
144 Gavgani AS, Hodjati MH, Mohite H. et al. Effect of insecticide-impregnated dog collars on incidence of zoonotic visceral leishmaniasis in Iranian children: a matched-cluster randomised trial. Lancet 2002; 360 (9330) 374-379 DOI: 10.1016/s0140-6736(02)09609-5.
145 Alexander B, Maroli M. Control of phlebotomine sandflies. Med Vet Entomol 2003; 17 (01) 1-18 DOI: 10.1046/j.1365-2915.2003.00420.x.
146 Maroli M, Gradoni L, Oliva G. et al. Guidelines for prevention of leishmaniasis in dogs. J Am Vet Med Assoc 2010; 236 (11) 1200-1206 DOI: 10.2460/javma.236.11.1200.
147 Velez R, Gallego M. Commercially approved vaccines for canine leishmaniosis: a review of available data on their safety and efficacy. Trop Med Int Health 2020; 25 (05) 540-557 DOI: 10.1111/tmi.13382.
148 Lemesre JL, Holzmuller P, Goncalves RB. et al. Long-lasting protection against canine visceral leishmaniasis using the LiESAp-MDP vaccine in endemic areas of France: double-blind randomised efficacy field trial. Vaccine 2007; 25 (21) 4223-4234 DOI: 10.1016/j.vaccine.2007.02.083.
149 Cacheiro-Llaguno C, Parody N, Renshaw-Calderon A. et al. Vaccination with LetiFend(R) reduces circulating immune complexes in dogs experimentally infected with L. infantum. Vaccine 2020; 38 (04) 890-896 DOI: 10.1016/j.vaccine.2019.10.078.
150 Molano I, Alonso MG, Miron C. et al. A Leishmania infantum multi-component antigenic protein mixed with live BCG confers protection to dogs experimentally infected with L. infantum. Vet Immunol Immunopathol 2003; 92 (01/02) 1-13 DOI: 10.1016/s0165-2427(02)00315-x.
151 Iniesta V, Fernández-Cotrina J, Solano-Gallego L. et al., editors Vaccination with LetiFend®, a novel canine leishmaniosis vaccine, does not interfere with serological diagnostic tests. X Southern European Veterinary Conference/51º Congreso Nacional Avepa; 2016 20–22 October 2016; Granada (Spain).
152 Saraiva EM, de Figueiredo Barbosa A, Santos FN. et al. The FML-vaccine (Leishmune) against canine visceral leishmaniasis: a transmission blocking vaccine. Vaccine 2006; 24 (13) 2423-2431 DOI: 10.1016/j.vaccine.2005.11.061.
153 Fernandes AP, Costa MM, Coelho EA. et al. Protective immunity against challenge with Leishmania (Leishmania) chagasi in beagle dogs vaccinated with recombinant A2 protein. Vaccine 2008; 26 (46) 5888-5895 DOI: 10.1016/j.vaccine.2008.05.095.