Inhalt
Einteilung und Ätiologie: Welche Formen von Morbus Addison gibt es?
Signalement: Welche Hunde sind besonders betroffen?
Klinische Präsentation: je nach Mangel vielfältig!
Diagnostik des Morbus Addison beim Hund
Differenzialdiagnosen: Morbus Addison ist leicht zu verwechseln!
Weiterführende Diagnostik: EKG, ACTH und Co.
Ein Addison entsteht durch eine unzureichende Funktion der Nebennierenrinde. Sie ist entsprechend ihrer hormonellen Produktion in 3 verschiedene Zonen unterteilt. In der Zona glomerulosa werden die Mineralokortikoide (z. B. Aldosteron) gebildet. Glukokortikoide (z. B. Kortisol) werden in allen 3 Zonen, vornehmlich aber in der Zona fasciculata und der Zona reticularis produziert [1].
Einteilung und Ätiologie: Welche Formen von Morbus Addison gibt es?
Primärer klassischer Addison
Beim klassischen primären Hypoadrenokortizismus, der häufigsten Form, kommt es zu einer Zerstörung aller 3 Zonen und damit einer verminderten Produktion von Mineralokortikoiden und Glukokortikoiden [2].
In den meisten Fällen ist eine immunmediierte Zerstörung der Nebennierenrinde die Ursache für den Mangel [3]. In der Humanmedizin sind verschiedene Autoantikörper gegen steroidbildende Enzyme nachgewiesen worden [4]. Auch beim Hund gibt es dafür Hinweise [5]. Histologisch zeigen betroffene Hunde eine lymphoplasmazelluläre Adrenalitis und Atrophie als Ausdruck eines immunmediierten Prozesses [3], [6]. Die Nebennieren werden folglich klein.
Seltenere Möglichkeiten einer Zerstörung der Nebennierenrinde sind:
- bilaterale Neoplasien [7], [8], [9]
- Infarkte
- meist granulomatöse Infektionen
Eine Sonderform stellt der iatrogene Addison dar. Bei mit Trilostan behandelten Cushing-Patienten treten Symptome eines Hypoadrenokortizismus in den meisten Fällen nur transient auf und verschwinden nach Anpassung der Dosis.
In der Literatur finden sich Hinweise, dass Ketokonazol und Delmadinoacetat zu einem transienten Hypoadrenokortizismus führen können [10], [11].
Atypischer Addison
Einige Patienten zeigen Symptome eines Glukokortikoidmangels ohne gleichzeitige Hinweise auf einen Hypoaldosteronismus. Bei ihnen bestehen demnach keine typischen Elektrolytveränderungen [12], [13]. Diese Form des Hypoadrenokortizismus wird als atypischer Addison bezeichnet.
In einer Studie zeigte sich, dass Hunde mit atypischem Hypoadrenokortizismus niedrige prä- und poststimulatorische Aldosteronlevel haben. Folglich besteht kein exklusiver Mangel an Glukokortikoiden. Die Autoren der Studie postulieren, dass der Mangel an Aldosteron über die Niere kompensiert wird [14].
Sekundärer Addison
Im Gegensatz zum primären Hypoadrenokortizismus ist ein sekundärer Addison sehr selten. Destruktive Prozesse im Hypothalamus oder der Hypophyse durch Neoplasie, Entzündung, Infektion, Infarkt oder Trauma können zu einem Mangel an CRH (Corticotropin-releasing Hormone) oder ACTH und damit zu einer fehlenden Stimulation der Nebennierenrinde führen. Die Folge ist ein reiner Glukokortikoidmangel. Obwohl es Patienten mit rein funktionellen Symptomen gibt, treten meist zusätzlich neurologische Symptome auf [1], [15].
Eine Sonderform stellt der iatrogene sekundäre Hypoadrenokortizismus bei längerfristiger Gabe von Glukokortikoiden dar. Durch das negative Feedback wird die ACTH-Sekretion supprimiert und die hormonelle Produktion der Nebennierenrinde pausiert. Ein plötzliches Absetzen führt dazu, dass keine eigene Sekretion geschieht und Symptome des Mangels auftreten. Es dauert mitunter Wochen, bis die normale Regulation und Produktion wieder in Gang gesetzt werden.
Aus diesem Grund sollten Glukokortikoide bei Langzeitgabe immer sukzessive ausgeschlichen werden [16].
Signalement: Welche Hunde sind besonders betroffen?
Anders als bei vielen endokrinologischen Erkrankungen sind beim Addison eher junge bis mittelalte Hunde betroffen. Bei der klassischen Form ist das mediane Alter 4 Jahre. Die Spanne liegt allerdings sehr weit von 2 Monaten bis 12 Jahren [17]. Patienten mit einem atypischen Addison sind tendenziell etwas älter [12], [13].
Hündinnen sind deutlich häufiger betroffen, der Anteil weiblicher Tiere liegt beim klassischen Addison bei bis zu 70% [17].
Mehrere Rassen sind für einen Addison prädisponiert [17], [18], [19], [20], [21]:
- Bearded Collie
- Standard Pudel
- Portugiesischer Wasserhund
- Springer Spaniel
- Cocker Spaniel
- Nova Scotia Duck Tolling Retriever
- Labrador Retriever
- West Highland White Terrier
Klinische Präsentation: je nach Mangel vielfältig!
Die klinischen Symptome sind unspezifisch. Am häufigsten treten Lethargie, Anorexie, Gewichtsverlust, Erbrechen und Durchfall auf. Diese Symptome können bereits länger bestehen, intermittierend auftreten und nur mild ausgeprägt sein. Andere Patienten zeigen einen progressiv schlechter werdenden Verlauf und werden als Notfall im hypovolämischen Schock vorgestellt. Dieser Zustand wird auch als Addisonkrise bezeichnet.
Die klinische Präsentation richtet sich nach dem dominierenden hormonellen Mangel bzw. dessen Kompensation: Durch den Mineralokortikoidmangel entsteht eine verminderte Rückresorption von Natrium und Wasser an der Niere und demnach ein Verlust in den Urin. Die Folge ist Polyurie und kompensatorisch Polydipsie. Der Flüssigkeitsverlust führt zu einer Dehydratation, Hypotension und Schwäche. Eine schwere Hyponatriämie führt zu zentralnervösen Ausfallerscheinungen. Gleichzeitig mit der fehlenden Natriumrückresorption kann Kalium nicht mehr in den Urin ausgeschieden werden und akkumuliert im Körper. Eine Hyperkaliämie ist potenziell lebensbedrohlich; die Auswirkungen zeigen sich am deutlichsten in der elektrischen Herzaktivität. Eine Bradykardie tritt bei 17% der Hunde auf [22].
Glukokortikoide sind essenziell für die Aufrechterhaltung der gastrointestinalen Schleimhautbarriere. Ein Glukokortikoidmangel äußert sich in Anorexie, Abdominalschmerz, Erbrechen und Durchfall. Ein massiver Mangel kann zudem zu einer unzureichenden Glukoneogenese und Glykogenolyse führen, eine Hypoglykämie ist dann die Folge. Lethargie, Schwäche, Zittern und Kollaps können demnach auch die klinischen Auswirkungen einer Hypoglykämie sein. Generell zeigen Patienten mit der atypischen Form die gleichen klinischen Symptome. Sie zeigen häufiger einen chronischen Verlauf und haben ein geringeres Risiko in eine Addisonkrise abzurutschen [12], [13], [23].
Diagnostik des Morbus Addison beim Hund
Hämatologie
Typische hämatologische Befunde sind eine milde nicht regenerative Anämie und das Fehlen eines Stressleukogramms bei einem kranken Patienten. Gelegentlich lässt sich ein umgekehrtes Stressleukogramm mit Lymphozytose und Eosinophilie nachweisen [16], [24].
Klinische Chemie
Die häufigsten Abweichungen in der Blutchemie eines Addisonpatienten sind:
- Hyperkaliämie
- Hyponaträmie
- Hypochlorämie
Ein Natrium/Kalium-Quotient von < 27 gilt als hinweisend auf einen Hypoadrenokortizismus [24]. Je geringer das Verhältnis, desto höher ist die Wahrscheinlichkeit, dass ein Addison vorliegt [22], [24], [25]. Das Natrium/Kalium-Verhältnis sollte jedoch mit Vorsicht interpretiert werden, da es wenig spezifisch ist. Eine Vielzahl von anderen Erkrankungen führt ebenfalls zu einem erniedrigten Verhältnis [25], [26]. Umgekehrt weisen nicht alle an Addison erkrankten Hunde eine Hyponatriämie und/oder Hyperkaliämie auf [12], [25]. Aus diesem Grund sollten die Differenzialdiagnosen für Hyperkaliämie und Hyponatriämie separat bedacht werden.
Weitere mögliche Befunde in der Blutuntersuchung:
- Azotämie
- Hyperphosphatämie
- Hypoalbuminämie
- Hypocholesterinämie
- Hypoglykämie
- erhöhte Leberenzyme
- Hyperkalzämie
- metabolische Azidose
Harnuntersuchung
Die Harnuntersuchung liefert keine spezifischen Befunde. Ein moderat reduziertes spezifisches Gewicht von < 1,020 ist meistens zu finden.
Differenzialdiagnosen: Morbus Addison ist leicht zu verwechseln!
Aufgrund der unspezifischen Symptome, aber auch der vielfältigen labordiagnostischen Veränderungen kann ein Hypoadrenokortizismus leicht mit anderen Erkrankungen verwechselt werden. Insbesondere zu Beginn der Diagnostik ist die Abgrenzung zum akuten Nierenversagen oft schwierig. Die reduzierte Natriumrückresorption hat eine verminderte Konzentrationsfähigkeit des Primärharns der Nieren zur Folge. Der Patient dehydriert durch den Wasserverlust. Eine prärenale Azotämie und eine Hyperphosphatämie sind deshalb häufige Befunde. Beim Addison funktioniert die Differenzierung prärenal/renal durch die Harnuntersuchung nicht. Durch die verminderte Natriumrückresorption und der damit vermehrten Wasserausscheidung ist das spezifische Gewicht bei einem Hypoadrenokortizismus trotz Dehydratation erniedrigt. Mit adäquater Infusionstherapie bessert sich ein Hund mit Hypoadrenokortizismus jedoch normalerweise signifikant innerhalb den ersten 24 – 48 Stunden. Bis die Ergebnisse des ACTH-Stimulationstests vorliegen, ist die Abgrenzung zum Nierenversagen daher oft nur über den Therapieverlauf möglich [16].
Bei einem Hund mit erhöhten Leberenzymen, Hypoalbuminämie, Hypocholesterinämie und Hypoglykämie muss differenzialdiagnostisch an eine Leberinsuffizienz gedacht werden. Im Gegensatz zum Leberversagen sind bei einem Hypoadrenokortizismus aber normale Serumgallensäuren zu erwarten.
Bei der diagnostischen Abklärung von Patienten mit chronischem Erbrechen, Durchfall oder Gewichtsverlust sollte ein Hypoadrenokortizismus berücksichtigt werden.
Eine Protein-losing-Enteropathie weist mit Hypoalbuminämie und Hypocholesterinämie zudem ähnliche labordiagnostische Veränderungen auf. Bei verschiedenen gastrointestinalen Infektionen wurde ein erniedrigtes Natrium/Kalium-Verhältnis beschrieben [27], [28].
Weiterführende Diagnostik: EKG, ACTH und Co.
Bildgebende Verfahren
Die Ultraschalluntersuchung des Abdomens dient zum einen der Beurteilung der Nebennieren, aber auch zum Ausschluss anderer Differenzialdiagnosen. Bilateral kleine Nebennieren sind hinweisend für einen Hypoadrenokortizismus.
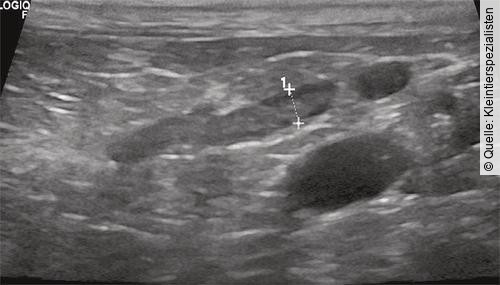
Sonografisches Bild der linken Nebenniere eines Hundes mit nachgewiesenem Hypoadrenokortizismus. Ein Durchmesser von < 3,2 mm gemessen am linken kaudalen Nebennierenpol ist hinweisend für einen Addison.
Ein Durchmesser des kaudalen Pols der linken Nebenniere von < 3,2 mm gilt als hinweisend [29]. Normal große Nebennieren schließen einen primären Hypoadrenokortizismus nicht aus. Bilateral vergrößerte Nebennieren können ein Hinweis auf eine neoplastische oder inflammatorische Genese sein.
Röntgenologisch sind die Folgen der Hypovolämie sichtbar: Mikrokardie, Mikrohepatie sowie eine schmale V. cava caudalis sind häufige Befunde [30].
Bei einem atypischen Hypoadrenokortizismus sind die labordiagnostischen und bildgebenden Befunde weniger auffällig, sodass dieser leicht übersehen werden kann. Natrium und Kalium sind im Referenzbereich, eine prärenale Azotämie fehlt. Mit reinem Glukokortikoidmangel einhergehende Laborveränderungen wie Hypalbuminämie, Hypocholesterinämie und Hypoglykämie sind möglich. Meist ist eine milde Anämie vorhanden. Die Nebennieren sind wie bei der klassischen Form klein [23].
Elektrokardiografie (EKG)
Bei jedem Patienten mit einer Bradykardie sollte ein EKG durchgeführt werden.
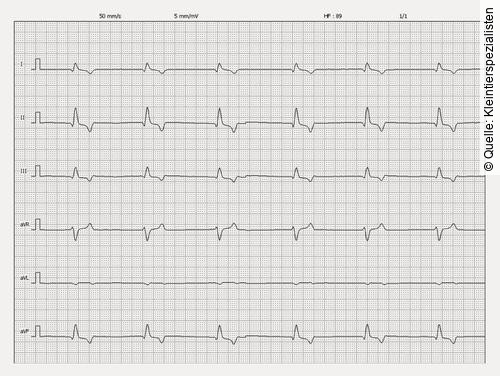
EKG eines 5-jährigen männlichen Hütehunds, der in der Addisonkrise vorgestellt wurde. Das Kalium lag bei 9,5 mmol/l. Auffällig sind weite QRS-Komplexe sowie fehlende P-Wellen.
Zu den Hyperkaliämie-assoziierten EKG-Veränderungen gehören:
- zeltförmige T-Wellen
- weite, niedrige QRS-Komplexe
- Absenkung der ST-Strecke
- niedrige, breite P-Wellen
- Verlust von P-Wellen
- Vorhofstillstand
- Sinewave-Konfiguration (sinuswellenartige Erscheinungen im EKG, die durch die Verschmelzung der breiten QRS-Komplexe und überhöhte T-Wellen zustande kommen), Kammerflimmern, Asystolie
Die Veränderungen im EKG sind jedoch nicht prädiktiv für das Ausmaß der Hyperkaliämie.
Spezifische Diagnostik
Basalkortisol
Die Bestimmung von Basalkortisol kann zum Ausschluss eines Hypoadrenokortizismus herangezogen werden. Bei einem Basalkortisol > 2 µg/ml ist ein Hypoadrenokortizismus sehr unwahrscheinlich [16], [31]. Ein niedriger Wert ist nicht beweisend und sollte immer durch einen ACTH-Stimulationstest abgeklärt werden. Besteht ein starker Verdacht auf einen Addison, ist das Basalkortisol nicht hilfreich und ein ACTH-Stimulationstest sollte durchgeführt werden.
ACTH-Stimulationstest
Dieser Inhalt unterliegt den Bestimmungen gemäß Heilmittelwerbegesetz (HWG) und darf nur berechtigten Personen zugänglich gemacht werden. Bitte loggen Sie sich ein, um diesen Inhalt zu sehen.
Endogenes ACTH
Die Bestimmung des endogenen ACTH dient primär der Differenzierung zwischen einem primären atypischen und einem sekundären Hypoadrenokortizismus nachdem die Erkrankung im ACTH-Stimulationstest bestätigt wurde. Die Messung von endogenem ACTH macht also dann Sinn, wenn keine Elektrolytabweichungen vorhanden sind. Im Fall eines primären Hypoadrenokortizismus ist ein hoher ACTH-Spiegel zu erwarten. Ein sekundärer Hypoadrenokortizismus ist durch einen niedrigen ACTH-Spiegel gekennzeichnet [2].
Die Unterscheidung zwischen den beiden Formen ist für den weiteren Verlauf entscheidend.
Bei der sekundären Form ist nicht mit der Entwicklung eines Mineralokortikoidmangels und den damit verbundenen Elektrolytabweichungen zu rechnen. Einige Patienten mit atypischem Addison entwickeln hingegen nach Monaten eine Hyponatriämie und Hyperkaliämie [12], [13], [33].
Kortisol-/ACTH-Verhältnis
Alternativ zum ACTH-Stimulationstest kann das Verhältnis aus Kortisol und endogenem ACTH bestimmt werden. An Addison erkrankte Hunde weisen einen geringeren Quotienten auf als gesunde oder anderweitig erkrankte. Allerdings gibt es Hunde mit nicht adrenalen Erkrankungen, welche ein vergleichsweise niedriges Kortisol-/ACTH-Verhältnis aufweisen [34], [35], [36]. Die Bestimmung von ACTH verlangt eine sorgsame Aufbereitung der Blutprobe, da ACTH sehr instabil ist.
1 Ettinger SJ, Feldmann EC. ed. Textbook of Veterinary Internal Medicine: Diseases of the Dog and the Cat. St. Louis, Missouri: Elsevier; 2017
2 Peterson ME, Kintzer PP, Kass PH. Pretreatment clinical and laboratory findings in dogs with hypoadrenocorticism: 225 cases (1979–1993). J Am Vet Med Assoc 1996; 208 (01) 85-91
3 Frank CB, Valentin SY, Scott-Moncrieff JC. et al. Correlation of inflammation with adrenocortical atrophy in canine adrenalitis. J Comp Pathol 2013; 149 (2 – 3): 268-279
4 Anderson JR, Goudie RB, Gray KG. et al. Auto-antibodies in Addisonʼs disease. Lancet 1957; 272: 1123-1124
5 Boag AM, Christie MR, McLaughlin KA. et al. A longitudinal study of autoantibodies against cytochrome P450 side-chain cleavage enzyme in dogs (Canis lupus familiaris) affected with hypoadrenocorticism (Addisonʼs disease). Vet Immunol Immunopathol 2018; 202: 41-45
6 Friedenberg SG, Lunn KF, Meurs KM. Evaluation of the genetic basis of primary hypoadrenocorticism in Standard Poodles using SNP array genotyping and whole-genome sequencing. Mamm Genome 2017; 28 (1 – 2): 56-65
7 Buckley ME, Chapman PS, Walsh A. Glucocorticoid-deficient hypoadrenocorticism secondary to intravascular lymphoma in the adrenal glands of a dog. Aust Vet J 2017; 95 (03) 64-67
8 Béguin JS, Chevallier L, Rannou B. et al. Primary hypoaldosteronism in a dog with pituitary and adrenal T-cell lymphoma. J Small Anim Pract 2018; DOI: 10.1111/jsap.12955.
9 Kook PH, Grest P, Raute-Kreinsen U. et al. Addisonʼs disease due to bilateral adrenal malignancy in a dog. J Small Anim Pract 2010; 51 (06) 333-336
10 Hernandez-Bures A, White AG, Riordan L. Presumptive iatrogenic hypoadrenocorticism induced by high-dose ketoconazole administration in a dog. J Vet Intern Med 2019; 33 (05) 2235-2238
11 Kempker K, Güssow A, Neiger R. Transient, secondary hypoadrenocorticism after treatment with delmadinone acetate (Tardastrex®) in a two year old male dog. Schweiz Arch Tierheilkd 2016; 158 (03) 193-197
12 Thompson AL, Scott-Moncrieff JC, Anderson JD. Comparison of classic hypoadrenocorticism with glucocorticoid-deficient hypoadrenocorticism in dogs: 46 cases (1985–2005). J Am Vet Med Assoc 2007; 230 (08) 1190-1194
13 Lifton SJ, King LG, Zerbe CA. Glucocorticoid deficient hypoadrenocorticism in dogs: 18 cases (1986–1995). J Am Vet Med Assoc 1996; 209 (12) 2076-2081
14 Baumstark ME, Nussberger J, Boretti FS. et al. Use of plasma renin activity to monitor mineralocorticoid treatment in dogs with primary hypoadrenocorticism: desoxycorticosterone versus fludrocortisone. J Vet Intern Med 2014; 28 (05) 1471-1478
15 Platt SR, Chrisman CL, Graham J. et al. Secondary hypoadrenocorticism associated with craniocerebral trauma in a dog. J Am Anim Hosp Assoc 1999; 35 (02) 117-122
16 Lathan P, Thompson AL. Management of hypoadrenocorticism (Addisonʼs disease) in dogs. Vet Med (Auckl) 2018; 9 (09) 1-10
17 Hanson JM, Tengvall K, Bonnett BN. et al. Naturally occuring adrenocortical insufficiency – an epidemiological study based on a Swedish-insured dog population of 525,028 dogs. J Vet Intern Med 2016; 30 (01) 76-84
18 Haviland RL, Toaff-Rosenstein RL, Reeves MP. et al. Clinical features of hypoadrenocorticism in soft-coated wheaten terrier dogs: 82 cases (1979–2013). Can Vet J 2016; 57 (04) 387-394
19 Shaker E, Hurvitz AI, Peterson ME. Hypoadrenocorticism in a family of Standard poodles. J Am Vet Med Assoc 1988; 192 (08) 1091-1092
20 Oberbauer AM, Bell JS, Belanger JM. et al. Genetic evaluation of Addisonʼs disease in the Portuguese Water Dog. BMC Vet Res 2006; 2: 2-15
21 Oberbauer AM, Benemann KS, Belanger JM. et al. Inheritance of hypoadrenocorticism in bearded collies. Am J Vet Res 2002; 63 (05) 643-647
22 Melián C, Peterson MC. Diagnosis and treatment of naturally occurring hypoadrenocorticism in 42 dogs. J Small Anim Pract 1996; 37 (06) 268-275
23 Wakayama JA, Furrow E, Merkel LK. et al. A retrospective study of dogs with atypical hypoadrenocorticism: a diagnostic cut-off or continuum?. J Small Anim Pract 2017; 58 (07) 365-371
24 Adler JA, Drobatz KJ, Hess RS. Abnormalities of serum electrolyte concentrations in dogs with hypoadrenocorticism. J Vet Intern Med 2007; 21 (06) 1168-1173
25 Nielsen L, Bell R, Zoia A. et al. Low ratios of sodium to potassium in the serum of 238 dogs. Vet Rec 2008; 162 (14) 431-435
26 Seth M, Drobatz KJ, Church DB. et al. White blood cell count and the sodium to potassium ratio to screen for hypoadrenocorticism in dogs. J Vet Intern Med 2011; 25 (06) 1351-1356
27 Ruckstuhl N, Hoerauf A, Tomsa K. et al. Pseudohypoadrenocorticism in two Siberian huskies with gastrointestinal parasitoses. Schweiz Arch Tierheilkd 2002; 144 (02) 75-81
28 Venco L, Valenti V, Genchi M. et al. A dog with pseudo-addison disease associated with trichuris vulpis infection. J Parasitol Res 2011; 2011: 68203
29 Wenger M, Mueller C, Kook PH. et al. Ultrasonographic evaluation of adrenal glands in dogs with primary hypoadrenocorticism or mimicking diseases. Vet Rec 2010; 167 (06) 207-210
30 Melián C, Stefanacci J, Peterson ME. et al. Radiographic findings in dogs with naturally-occuring primary hypoadrenocorticism. J Am Anim Hosp Assoc 1999; 35 (03) 208-212
31 Gold AJ, Langlois DK, Refsal KR. Evaluation of basal serum or plasma cortisol concentrations for the diagnosis of hypoadrenocorticism in dogs. J Vet Intern Med 2016; 30 (06) 1798-1805
32 Lathan P, Moore GE, Zambon S. et al. Use of a low-dose ACTH stimulation test for diagnosis of hypoadrenocorticism in dogs. J Vet Intern Med 2008; 22: 1070-1073
33 Richartz J, Neiger R. Hypoadrenocorticism without classic electrolyte abnormalities in seven dogs. Tierarztl Prax Ausg K Kleintiere Heimtiere 2011; 39 (03) 163-169
34 Lathan P, Scott-Moncrieff JC, Wills RW. Use of the cortisol-to-ACTH ratio in diagnosis of primary hypoadrenocorticism in dogs. J Vet Intern Med 2014; 28 (05) 1546-1550
35 Boretti FS, Meyer F, Burkhardt WA. et al. Evaluation of the cortisol-to-ACTH ratio in dogs with hypoadrenocorticism, dogs with diseases mimicking hypoadrenocorticism and in healthy dogs. J Vet Intern Med 2015; 29 (05) 1335-1341
36 Javadi S, Galac S, Boer P. et al. Aldosterone-to-renin and cortisol-to-adrenocorticotropic hormone ratios in healthy dogs and dogs with primary hypoadrenocorticism. J Vet Intern Med 2006; 20 (03) 556-561
37 Schaer M. The treatment of acute adrenocortical insufficiency in the dog. J Vet Emerg Crit Care 2001; 11 (01) 7-14
38 Feldmann EC, Nelson RW, Reusch C, Scott-Moncrieff JC. Canine and Feline Endocrinology. 4th ed. London: Elsevier Saunders; 2014
39 Brady CA, Vite CH, Drobatz KJ. Severe neurologic sequelae in a dog after treatment of hypoadrenal crisis. J Am Vet Med Assoc 1999; 215 (02) 222-225 210
40 MacMillan KL. Neurologic complications following treatment of canine hypoadrenocorticism. Can Vet J 2003; 44 (06) 490-492
41 Klein SC, Peterson ME. Canine hypoadrenocorticism: part 2. Can Vet J 2010; 51 (02) 179-184
42 Gunn E, Shiel RE, Mooney CT. Hydrocortisone in the management of hypoadrenocorticism in dogs: a retrospective series of 30 cases. J Small Anim Pract 2016; 57: 227-233
43 Oelkers W, Diederich S, Bähr V. Diagnosis and therapy surveillance in Addisonʼs disease: rapid adrenocorticotropin (ACTH) test and measurement of plasma ACTH, renin activity, and aldosterone. J Clin Endocrinol Metab 1992; 75 (01) 259-264
44 Bates JA, Shott S, Schall WD. Lower initial dose desoxycorticosterone pivalate for treatment of canine primary hypoadrenocorticism. Aust Vet J 2013; 91 (03) 77-82
45 Kintzer PP, Peterson ME. Treatment and long-term follow-up of 205 dogs with hypoadrenocorticism. J Vet Intern Med 1997; 11 (02) 43-49
46 Sieber-Ruckstuhl NS, Reusch CE, Hofer-Inteeworn N. et al. Evaluation of a low-dose desoxycorticosterone pivalate treatment protocol for long-term management of dogs with primary hypoadrenocorticism. J Vet Intern Med 2019; 33: 1266-1271
47 Jaffey JA, Nurre P, Cannon AB. et al. Desoxycorticosterone pivalate duration of action and individualized dosing intervals in dogs with primary hypoadrenocorticism. J Vet Intern Med 2017; 31 (06) 1649-1657
48 Spence S, Gunn E, Ramsey I. Diagnosis and treatment of canine hypoadrenocorticism. In Practice 2018; 40: 281-290
49 Roberts E, Boden LA, Ramsey IK. Factors that affect stabilisation times of canine spontaneous hypoadrenocorticism. Vet Rec 2016; 179 (04) 98
50 Zeugswetter FK, Haniger T. Prednisolon dosages in Addisonian dogs after integration of ACTH measurement into treatment surveillance. Tierarztl Prax Ausg K Kleintiere Heimtiere 2018; 46 (02) 90-96